Notícia
Comissão Europeia espera primeira autorização para vacinas em dezembro
Todas as vacinas "vão ser avaliadas rigorosamente pela EMA antes de serem autorizadas" na União Europeia, nomeadamente as cinco que o executivo comunitário já contratualizou com várias farmacêuticas, disse Ursula von der Leyen.
19 de Novembro de 2020 às 23:16
A Comissão Europeia disse hoje que a Agência Europeia de Medicamentos (EMA) poderá dar uma primeira autorização comercial às vacinas para a covid-19 desenvolvidas pela BioNTech e Pfizer e pela Moderna na segunda metade de dezembro.
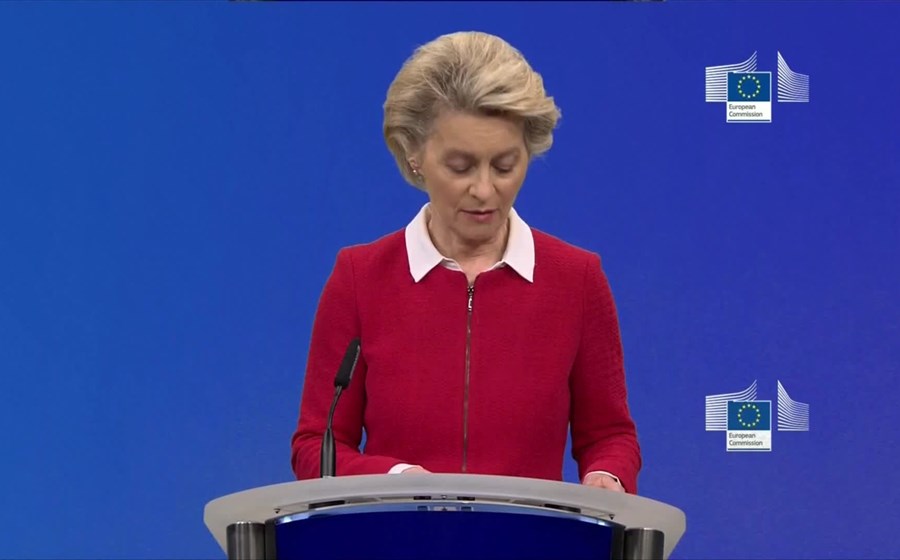
"A EMA diz-nos que a autorização condicional de mercado - que é ainda uma de fase muito inicial - pode acontecer já na segunda metade de dezembro, se tudo correr sem qualquer problema", declarou a presidente da Comissão Europeia, Ursula von der Leyen (na foto).
Falando em conferência de imprensa, em Bruxelas, após um Conselho Europeu por videoconferência sobre a pandemia de covid-19, a responsável assegurou que todas as vacinas "vão ser avaliadas rigorosamente pela EMA antes de serem autorizadas" na União Europeia (UE), nomeadamente as cinco que o executivo comunitário já contratualizou com várias farmacêuticas.
"Claro que, de início, receberemos apenas poucas doses e as maiores só surgirão depois", recordou Ursula von der Leyen, notando que os países têm de "ter isso em mente" nos planos de vacinação para a covid-19, em que vão definir os grupos prioritários a vacinar.
"A recomendação é de [vacinar] primeiro trabalhadores do setor da saúde e outros essenciais, os idosos, pessoas com outras doenças associadas", recordou Ursula von der Leyen.
Até ao momento, a Comissão Europeia já assinou cinco contratos com farmacêuticas para assegurar vacinas para a Europa quando estas se revelarem eficazes e seguras: a AstraZeneca (300 milhões de doses), a Sanofi-GSK (300 milhões), Johnson & Johnson (200 milhões) e BioNTech e Pfizer (300 milhões) e CureVac (405 milhões).
"Adotámos até ao momento cinco contratos [...] e continuamos em negociações com a Moderna e agora estamos em conversações com a Novavax", apontou hoje Ursula von der Leyen.
A responsável argumentou que "este portefólio é importante porque abrange quatro diferentes tecnologias e é possível que diferentes vacinas sejam mais adequadas para diferentes camadas da população".
Ursula von der Leyen afirmou, ainda, que a EMA está em "contacto diário" com a reguladora farmacêutica norte-americana para "sincronizar a avaliação" das vacinas, nomeadamente as desenvolvidas pela BioNTech e Pfizer e pela Moderna.
Esta semana, a norte-americana Moderna disse que a sua vacina poderá ser 94,5% eficaz, de acordo com dados preliminares dos estudos clínicos em curso.
Também nos últimos dias, as farmacêuticas norte-americana Pfizer e alemã BioNTech elevaram para 95% a eficácia da sua vacina contra o novo coronavírus, segundo os resultados finais e completos do ensaio clínico em larga escala.
Previsto está que as vacinas asseguradas pela Comissão Europeia sejam disponibilizadas ao mesmo tempo para todos os Estados-membros da UE, sendo que a quantidade atribuída a cada será baseada na população.
A compra também é feita por cada país.
"A EMA diz-nos que a autorização condicional de mercado - que é ainda uma de fase muito inicial - pode acontecer já na segunda metade de dezembro, se tudo correr sem qualquer problema", declarou a presidente da Comissão Europeia, Ursula von der Leyen (na foto).
"Claro que, de início, receberemos apenas poucas doses e as maiores só surgirão depois", recordou Ursula von der Leyen, notando que os países têm de "ter isso em mente" nos planos de vacinação para a covid-19, em que vão definir os grupos prioritários a vacinar.
"A recomendação é de [vacinar] primeiro trabalhadores do setor da saúde e outros essenciais, os idosos, pessoas com outras doenças associadas", recordou Ursula von der Leyen.
Até ao momento, a Comissão Europeia já assinou cinco contratos com farmacêuticas para assegurar vacinas para a Europa quando estas se revelarem eficazes e seguras: a AstraZeneca (300 milhões de doses), a Sanofi-GSK (300 milhões), Johnson & Johnson (200 milhões) e BioNTech e Pfizer (300 milhões) e CureVac (405 milhões).
"Adotámos até ao momento cinco contratos [...] e continuamos em negociações com a Moderna e agora estamos em conversações com a Novavax", apontou hoje Ursula von der Leyen.
A responsável argumentou que "este portefólio é importante porque abrange quatro diferentes tecnologias e é possível que diferentes vacinas sejam mais adequadas para diferentes camadas da população".
Ursula von der Leyen afirmou, ainda, que a EMA está em "contacto diário" com a reguladora farmacêutica norte-americana para "sincronizar a avaliação" das vacinas, nomeadamente as desenvolvidas pela BioNTech e Pfizer e pela Moderna.
Esta semana, a norte-americana Moderna disse que a sua vacina poderá ser 94,5% eficaz, de acordo com dados preliminares dos estudos clínicos em curso.
Também nos últimos dias, as farmacêuticas norte-americana Pfizer e alemã BioNTech elevaram para 95% a eficácia da sua vacina contra o novo coronavírus, segundo os resultados finais e completos do ensaio clínico em larga escala.
Previsto está que as vacinas asseguradas pela Comissão Europeia sejam disponibilizadas ao mesmo tempo para todos os Estados-membros da UE, sendo que a quantidade atribuída a cada será baseada na população.
A compra também é feita por cada país.